受理號:JQZ2100255
醫(yī)療器械產(chǎn)品注冊技術(shù)審評報告
產(chǎn)品中文名稱:血管內(nèi)沖擊波治療設(shè)備
產(chǎn)品英文(原文)名稱:
Shockwave Peripheral Intravascular?Lithotripsy (IVL) Catheter?
申請人名稱:Shockwave Medical, Inc.
一、申請人名稱
Shockwave Medical, Inc.
二�����、申請人住所
5403 Betsy Ross Drive Santa Clara,CA USA 95054
三�、生產(chǎn)地址
5403 Betsy Ross Drive Santa Clara,CA USA 95054
技術(shù)審評概述
(一)產(chǎn)品結(jié)構(gòu)及組成
產(chǎn)品由發(fā)生器�、連接器電纜、輸液架支架�、充電模塊及電源線組成。
該產(chǎn)品在醫(yī)療機(jī)構(gòu)使用�����,與本公司生產(chǎn)的一次性使用冠脈血管內(nèi)沖擊波導(dǎo)管�、一次性使用外周血管內(nèi)沖擊波導(dǎo)管配合,用于對血管內(nèi)鈣化病變進(jìn)行預(yù)處理及球囊擴(kuò)張�。產(chǎn)品適應(yīng)證以配合使用導(dǎo)管所批準(zhǔn)的適用范圍為準(zhǔn)���,可配用導(dǎo)管型號見產(chǎn)品技術(shù)要求附錄�����。
該產(chǎn)品為用于血管內(nèi)沖擊波治療的能量發(fā)生器�����,預(yù)期與本公司生產(chǎn)的一次性使用外周/冠脈血管內(nèi)沖擊波導(dǎo)管配合使用���,用于對外周或冠脈血管鈣化病變進(jìn)行處理和擴(kuò)張����。
該產(chǎn)品基于體外碎石沖擊波原理改進(jìn)而來����,將聚焦式高強(qiáng)度能量改為發(fā)散式低強(qiáng)度能量,為血管內(nèi)導(dǎo)管提供能量以產(chǎn)生沖擊波對鈣化病變部位進(jìn)行松解��,從而緩解血管狹窄程度或便于后續(xù)治療��。目前尚無同樣原理和使用方式的產(chǎn)品在我國獲準(zhǔn)注冊�。
產(chǎn)品發(fā)生器為內(nèi)部電源設(shè)備��,需充電使用����,通過連接器電纜與血管內(nèi)沖擊波導(dǎo)管相連�����,連接部位采用磁吸方式進(jìn)行固定����。設(shè)備內(nèi)部軟件可識別導(dǎo)管型號,并自動設(shè)定相應(yīng)輸出脈沖序列和脈沖個數(shù)��。不同導(dǎo)管的單脈沖輸出能量相同���,單次脈沖數(shù)和可用脈沖總數(shù)存在差異���,使用者不能對輸出參數(shù)和輸出個數(shù)進(jìn)行調(diào)節(jié),僅可控制啟動輸出����。設(shè)備還可判斷導(dǎo)管是否已使用,以及記錄并存儲當(dāng)前激發(fā)脈沖數(shù)�����。
申請人提供了產(chǎn)品性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說明��,給出了能量輸出參數(shù)��、連接力��、識別功能�、電氣安全和電磁兼容等功能性��、安全性指標(biāo)以及與質(zhì)量控制相關(guān)的其他指標(biāo)的確定依據(jù)���。產(chǎn)品技術(shù)要求中各指標(biāo)參考了相關(guān)的國家����、行業(yè)標(biāo)準(zhǔn)���,包括:GB 9706.1-2007��、YY 0505-2012�。
產(chǎn)品使用期限為3年�����,申請人通過分析各關(guān)鍵部件的使用壽命,并對整機(jī)可輸出脈沖總數(shù)進(jìn)行測試�����,驗證產(chǎn)品可耐受的脈沖輸出總數(shù)和累計使用時間���,并按照實際使用頻率換算可等效為3年�。同時提供了電池使用壽命的驗證資料��,驗證電池可滿足預(yù)設(shè)使用期限內(nèi)的充放電次數(shù)�,并且在使用末期的電量仍能滿足預(yù)設(shè)臨床使用需求。
申請人按照《醫(yī)療器械軟件注冊技術(shù)審查指導(dǎo)原則》的要求�����,提交了軟件描述文檔�����。產(chǎn)品含3個不同的獨立軟件模塊�,分別給出了相應(yīng)的技術(shù)資料和版本信息,各軟件模塊版本與總版本號關(guān)聯(lián)。發(fā)布版本號為02.23����。產(chǎn)品不含數(shù)據(jù)交互功能,不涉及網(wǎng)絡(luò)安全研究���。
申請人提供了產(chǎn)品在豬體內(nèi)模型中開展的慢性動物試驗對照研究資料���,評價產(chǎn)品將沖擊波能量輸送到外周動脈/冠狀動脈的安全性和血管效應(yīng)。分別配合外周和冠脈導(dǎo)管模擬臨床使用情況進(jìn)行血管內(nèi)沖擊波治療�����,使用不同導(dǎo)管的最大可耐受能量對不同部位的血管進(jìn)行試驗�����,治療后隨訪28天�����。結(jié)果顯示�,全部動物均存活至隨訪期末����,治療過程中未出現(xiàn)并發(fā)癥�����,各治療部位影像學(xué)檢查未發(fā)現(xiàn)明確管腔狹窄或血流不暢��,病理學(xué)檢查顯示治療部位組織和正常組織形態(tài)相似�,動物體征健康����。
申請人提供了基于外周/冠脈各個不同系列導(dǎo)管的沖擊波聲壓能量分布研究測試報告。模擬實際臨床使用狀態(tài)���,使用1:1混合液在規(guī)定氣壓條件下充盈球囊��,分別測試不同導(dǎo)管的輸出特性�,測量并計算每個單一波源在球囊界面方向上的聲壓傳輸范圍��,以及所有波源能量疊加后的覆蓋區(qū)域�。結(jié)果證實產(chǎn)品沖擊波能量范圍和強(qiáng)度可涵蓋預(yù)期治療部位。
產(chǎn)品符合醫(yī)用電氣相關(guān)通用安全標(biāo)準(zhǔn)(GB 9706.1-2007)和并列安全標(biāo)準(zhǔn)(YY 0505-2012)的要求����,提供由醫(yī)療器械檢驗機(jī)構(gòu)出具的符合標(biāo)準(zhǔn)要求的檢驗報告���。
該產(chǎn)品與一次性使用冠脈血管內(nèi)沖擊波導(dǎo)管或一次性使用外周血管內(nèi)沖擊波導(dǎo)管配合使用�����,申請人針對不同配合使用的導(dǎo)管進(jìn)行了臨床評價���。
(一)與一次性使用冠脈血管內(nèi)沖擊波導(dǎo)管配合使用
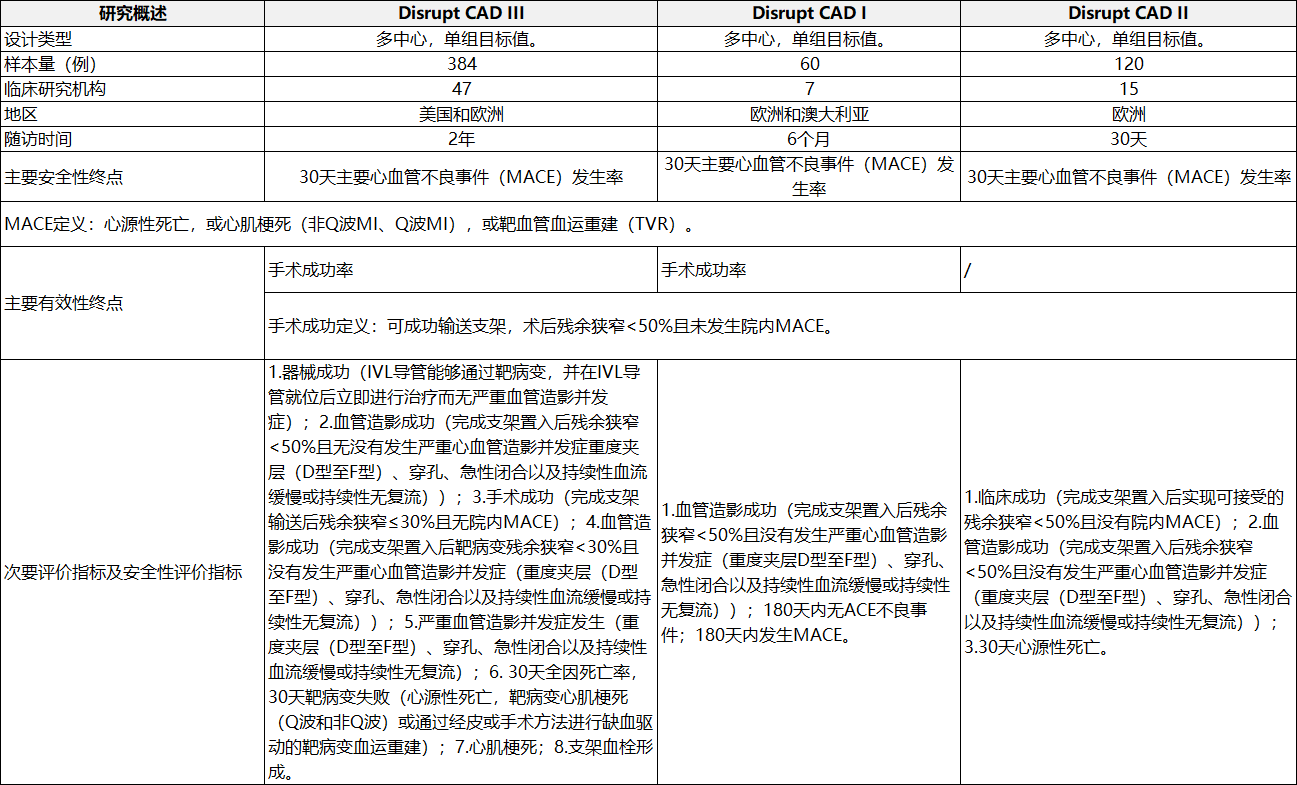
申請人采用臨床試驗路徑進(jìn)行臨床評價����,提交了境外臨床試驗數(shù)據(jù)����。臨床試驗?zāi)康臑樵u價一次性使用冠脈血管內(nèi)沖擊波導(dǎo)管在支架置入前用于治療冠狀動脈鈣化病變的安全性與有效性���。提交的臨床數(shù)據(jù)包括Disrupt CAD I�����、II���、III,其中Disrupt CAD III為IDE研究,Disrupt CAD I為上市前臨床試驗�����,Disrupt CAD II為歐洲上市后臨床研究���。
表1冠脈臨床研究概況
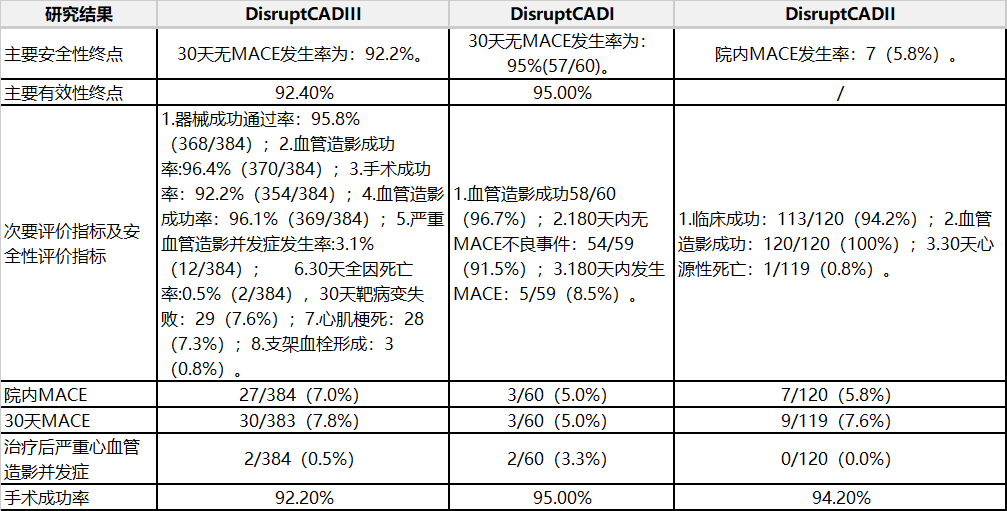
表2冠脈臨床研究結(jié)果2.冠脈臨床研究結(jié)果(見表2)���。
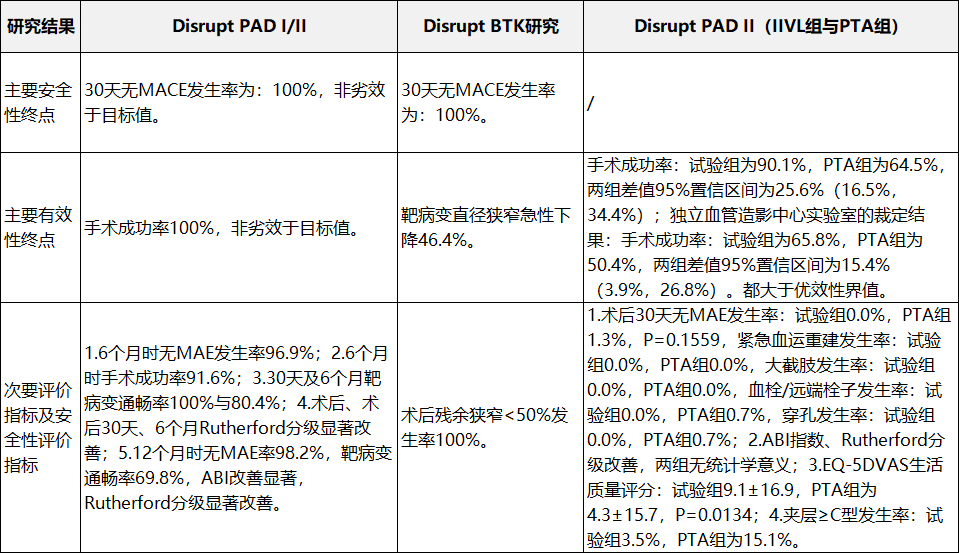
申請人采用臨床試驗路徑進(jìn)行臨床評價�,提交了境外臨床試驗數(shù)據(jù)����。臨床試驗?zāi)康臑樵u價一次性使用外周血管內(nèi)沖擊波導(dǎo)管用于治療下肢動脈鈣化病變的安全性與有效性。提交的臨床數(shù)據(jù)包括Disrupt PAD I�、II、III��,以及Disrupt BTK研究�,其中Disrupt PAD I/II、Disrupt BTK上市前臨床試驗�,Disrupt PAD III為美國上市后臨床研究。(二)一次性使用外周血管內(nèi)沖擊波導(dǎo)管配合使用
表3外周臨床研究概況
表4外周臨床研究結(jié)果2.外周臨床研究結(jié)果(見表4)。
四�����、產(chǎn)品受益風(fēng)險判定此外���,還提供了Disrupt PAD III臨床研究中的BTK亞組數(shù)據(jù)(共101例患者)�����,病變基線及臨床試驗結(jié)果與Disrupt PAD BTK臨床研究基本一致���。
該產(chǎn)品用于成人患者對外周血管鈣化病變或原發(fā)性冠狀動脈鈣化病變進(jìn)行預(yù)處理及球囊擴(kuò)張,主要受益是為患者提供了一種額外的鈣化病變處理手段��。主要風(fēng)險為臨床使用時的手術(shù)相關(guān)風(fēng)險�,特別是沖擊波可能導(dǎo)致的鈣化斑塊脫落風(fēng)險,以及不必要的使用或者操作不當(dāng)?shù)取?/span>
根據(jù)申請人提供的申報資料���,經(jīng)綜合評價,在目前認(rèn)知水平上��,認(rèn)為該產(chǎn)品的上市為適用人群帶來的受益大于風(fēng)險�����。
綜合評價意見
該產(chǎn)品為首個申報的同類醫(yī)療器械產(chǎn)品。依據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務(wù)院令第680號)��、《醫(yī)療器械注冊管理辦法》(原國家食品藥品監(jiān)督管理總局令第4號)等相關(guān)醫(yī)療器械法規(guī)與配套規(guī)章���,經(jīng)對申請人提交的注冊申報資料進(jìn)行系統(tǒng)評價,申報產(chǎn)品符合安全性��、有效性的要求����,符合現(xiàn)有認(rèn)知水平����,建議準(zhǔn)予注冊。
2022年5月6日