近日�����,天眼查數(shù)據(jù)顯示深圳市賽禾醫(yī)療發(fā)生工商變更���,新增廣西騰訊創(chuàng)業(yè)投資有限公司��、深圳市賽禾致遠(yuǎn)二號咨詢企業(yè)(有限合伙)等股東���;同時公司注冊資本從292.81萬元增加到394.07萬元。

據(jù)了解��,該公司成立于2020年����,主要業(yè)務(wù)涵蓋心腦血管、外周血管為代表的醫(yī)療領(lǐng)域�,致力于有源治療和診斷導(dǎo)管等高值耗材和器械的設(shè)計、開發(fā)�、制造和銷售。目前公司股權(quán)架構(gòu)中創(chuàng)始人劉斌持股30.45%為第一大股東����,廣西騰訊創(chuàng)業(yè)投資有限公司12.38%為第二大股東。?
賽禾醫(yī)療創(chuàng)立于2020年4月���,是一家研發(fā)和生產(chǎn)有源類血管植介入醫(yī)療器械的高科技企業(yè)��,主要產(chǎn)品包括沖擊波球囊導(dǎo)管、超聲波導(dǎo)管等有源介入高值醫(yī)用耗材�,產(chǎn)品覆蓋冠狀動脈疾病、外周血管疾病和結(jié)構(gòu)性心臟病等心腦血管臨床領(lǐng)域�。?

據(jù)了解,公司創(chuàng)始人劉斌曾在華為工作多年�,另外其產(chǎn)品開發(fā)團隊來自于知名醫(yī)療器械和ICT企業(yè),在醫(yī)學(xué)傳感器����、血管介入器械和主機系統(tǒng)等方面具有豐富的設(shè)計與開發(fā)經(jīng)驗,目前公司首個產(chǎn)品已經(jīng)進入臨床試驗階段��。?
國內(nèi)首個冠狀動脈沖擊波碎石系統(tǒng)?
2021年10月19日��,賽禾醫(yī)療自主研發(fā)的國內(nèi)首個冠狀動脈沖擊波碎石系統(tǒng)在空軍軍醫(yī)大學(xué)唐都醫(yī)院由心內(nèi)科李妍教授團隊完成首例臨床入組����,手術(shù)圓滿成功,充分展示了該創(chuàng)新器械的安全性和優(yōu)異的臨床效果��。?
據(jù)介紹,首例臨床試驗的入組患者為女性�����,其冠脈CTA及冠脈造影提示前降支近段重度狹窄80%合并重度鈣化�。?
整個手術(shù)過程中,從整體系統(tǒng)的連接�、沖擊波球囊的通過性和對中層及偏心鈣化的處理效果看,該冠狀動脈沖擊波碎石系統(tǒng)在術(shù)中表現(xiàn)優(yōu)異��,一個放電周期的處理(10秒)就看到鈣化狹窄處輕松打開�����。支架植入后膨脹理想���,無明顯殘余狹窄���。?

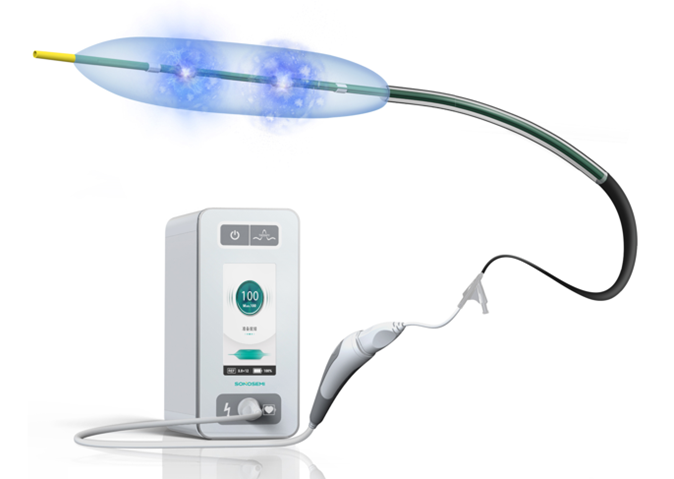
?LiqMagic C14沖擊波冠脈球囊導(dǎo)管
該設(shè)備是由沖擊波冠脈球囊導(dǎo)管LiqMagic C14、血管內(nèi)沖擊波治療儀ISL100 Pro兩部分組成����。沖擊波冠脈球囊導(dǎo)管和血管內(nèi)沖擊波治療儀連接后,通過操作手柄的控制按鍵能夠控制血管內(nèi)沖擊波治療儀的主機啟動或停止血管內(nèi)碎石治療�����,具備良好的安全性、便捷性和可靠性��。球囊內(nèi)部的遠(yuǎn)端和近端都有顯影環(huán)標(biāo)識�����,方便醫(yī)生精確定位�。?
在一級市場����,該公司也備受關(guān)注,除了此次騰訊入股之外�,該公司成立兩年來,便已完成兩輪融資���。最近的的一輪融資金額達(dá)到了近億人民幣:2021年6月28日�,賽禾醫(yī)療完成了近億元人民幣的Pre-A輪融資����。由睿筧資本領(lǐng)投,斯道資本跟投���,原股東久知心飛繼續(xù)跟投�����。?
所獲資金將主要用于沖擊波球囊導(dǎo)管的臨床實驗和其他血管介入醫(yī)療器械的產(chǎn)品開發(fā)���。未來該公司將在醫(yī)學(xué)傳感器芯片技術(shù)上保持持續(xù)技術(shù)創(chuàng)新��,推動基于新型醫(yī)學(xué)傳感器的高值耗材產(chǎn)品在醫(yī)療健康領(lǐng)域的大規(guī)模應(yīng)用�,持續(xù)為醫(yī)患創(chuàng)造價值����,做智慧醫(yī)療賦能者。?
科技巨頭跨界醫(yī)療在近幾年來屢見不鮮����,2021年9月騰訊自主研發(fā)的“肺炎CT影像輔助分診及評估軟件”正式獲批第三類醫(yī)療器械注冊證,騰訊也正式成為國內(nèi)互聯(lián)網(wǎng)科技行業(yè)首個獲得醫(yī)療AI三類證的企業(yè)��。?
在醫(yī)療器械領(lǐng)域��,騰訊在2017年便發(fā)布了一款 AI 醫(yī)學(xué)影像產(chǎn)品-騰訊覓影����。它能夠可以有效輔助醫(yī)生發(fā)現(xiàn)疾病病灶�,把病魔扼殺在搖籃里����。
除了自身的產(chǎn)品開發(fā)外,騰訊還通過合作���、投資等擴寬其在醫(yī)療器械領(lǐng)域的布局����。例如2019年與國際巨頭飛利浦中國區(qū)達(dá)成合作��,共同推進電子陰道鏡AI輔助診斷系統(tǒng)的研發(fā)�。?
包括最近與國內(nèi)醫(yī)械一哥邁瑞合作共同研發(fā)的全自動外周血細(xì)胞形態(tài)學(xué)分析儀完成創(chuàng)新醫(yī)療器械特別審查公示��,正式進入NMPA創(chuàng)新通道����。需要指出的是,這也是國內(nèi)體外診斷行業(yè)首個進入三類創(chuàng)新醫(yī)療器械特別審查程序的AI類產(chǎn)品��。
資料顯示��,在2021年1月�,邁瑞醫(yī)療就與騰訊AI Lab簽署了AI合作框架協(xié)議�,共同研發(fā)血液細(xì)胞分析的AI產(chǎn)品����,并進一步探索AI技術(shù)在體外診斷的融合與應(yīng)用。合作將依托騰訊覓影 · 開放實驗室����,加速科技部醫(yī)療影像國家新一代人工智能開放創(chuàng)新平臺的建設(shè),為大眾提供更優(yōu)質(zhì)的醫(yī)療設(shè)備與服務(wù)�。?
目前騰訊已成為醫(yī)療領(lǐng)域的投資大佬,在“互聯(lián)網(wǎng)+醫(yī)療”每一個細(xì)分賽道����,騰訊都會投資若干家公司。迄今騰訊已用逾200億元的投資�,將丁香園、微醫(yī)集團���、卓健科技�、醫(yī)聯(lián)��、好大夫在線��、企鵝醫(yī)生���、碳云智能等國內(nèi)大半的互聯(lián)網(wǎng)醫(yī)療獨角獸納入麾下�����,并在AI醫(yī)學(xué)�、醫(yī)學(xué)影像、醫(yī)美等醫(yī)療器械領(lǐng)域進行了布局����。?
根據(jù)國家心血管疾病中心發(fā)布的《中國心血管健康與疾病報告 2019》,目前我國心血管患病率近年持續(xù)上升�。2019年我國心血管患病人數(shù)約3.3億人,其中腦卒中1300萬人����,冠心病1100萬人,目前我國每年有超過100萬例冠脈介入手術(shù)����,其中約1 / 3的患者有中度至重度鈣化��。
PCI 手術(shù)是目前治療冠心病主流手段��,2009年到2019年�,我國冠心病介入治 療快速發(fā)展���,每年的病例數(shù)從23萬例發(fā)展到超過100萬例,年增長速度 10%~25%�����。2009年到2019年���,我國冠心病介入治療快速發(fā)展��,每年的病例數(shù)從23萬例發(fā)展到超過100萬例�����,年增長速度 10%~25%�����。
目前我國每年有超過100萬例冠脈介入手術(shù)��,其中約1 / 3的患者有中度至重度鈣化�;隨著我國人口老齡化日益嚴(yán)重����,以及冠心病患者數(shù)量不斷增加�,未來冠脈介入手術(shù)的需求將越來越大���,預(yù)計2024年手術(shù)量將超過190萬臺�����。在人均手術(shù)量上我國滲透率仍處于較低水平�����,2018年我國僅665人次/每百萬人����,而美國為2907人次/每百萬人��,是我國滲透率四倍以上����,未來國內(nèi)市場有巨大潛力。
傳統(tǒng)的血管鈣化治療技術(shù)存在許多局限�,無法安全有效地處理較嚴(yán)重的鈣化病變��。而賽禾醫(yī)療冠狀動脈沖擊波碎石系統(tǒng)�����,具備良好的安全性、便捷性和可靠性���。球囊內(nèi)部的遠(yuǎn)端和近端都有顯影環(huán)標(biāo)識�,方便醫(yī)生精確定位����,具備極大的優(yōu)勢。
在國外�,美國ShockwaveMedical是全球第一家也是唯一一家推出沖擊波球囊的公司。其治療冠脈血管鈣化的C2導(dǎo)管在一系列的DISRUPT CAD臨床研究中展現(xiàn)了巨大的臨床價值�����,并于2021年2月獲得美國FDA批準(zhǔn)上市���。而截止目前����,國內(nèi)尚無同類產(chǎn)品上市��。

ShockwaveMedicalC2導(dǎo)管
目前血管有源植入介入領(lǐng)域傳統(tǒng)旋磨術(shù)等冷時代走向冷、熱兵器雙管齊下的時代����,可以預(yù)見到未來3到5年國內(nèi)有源植介入賽道,將以國產(chǎn)化替代為契機����,迎來快速發(fā)展,該領(lǐng)域也值得被看好����。
隨著冠脈介入器械產(chǎn)品的越發(fā)成熟,以及在臨床應(yīng)用中的認(rèn)可度逐步提高�����,其手術(shù)滲透率將持續(xù)增加�����,進而將會推動整個器械市場的持續(xù)增長�����。近年來�����,全球血管介入耗材市場規(guī)模增速放緩��,保持在3%-5%�����,2018年全球血管介入器械市場規(guī)模達(dá)232億美元����。2019年我國血管介入器械市場規(guī)模約為480億元,同比增長23.39%�����,其中冠脈介入占了極大部分��,未來前景廣闊�����。?
此次騰訊增資賽禾醫(yī)療�,也說明了其對國內(nèi)冠脈鈣化治療市場的看好,相比傳統(tǒng)的血管鈣化治療技術(shù)存在許多局限�,而冠脈沖擊波碎石技術(shù)出現(xiàn)���,將會快速的替代原有的方式,未來市場空間絕大���。此外賽禾醫(yī)療產(chǎn)品已進入臨床試驗階段����,期待早日獲批���。
